( في الذرة المتعادلة )
الذرة المتعادلة

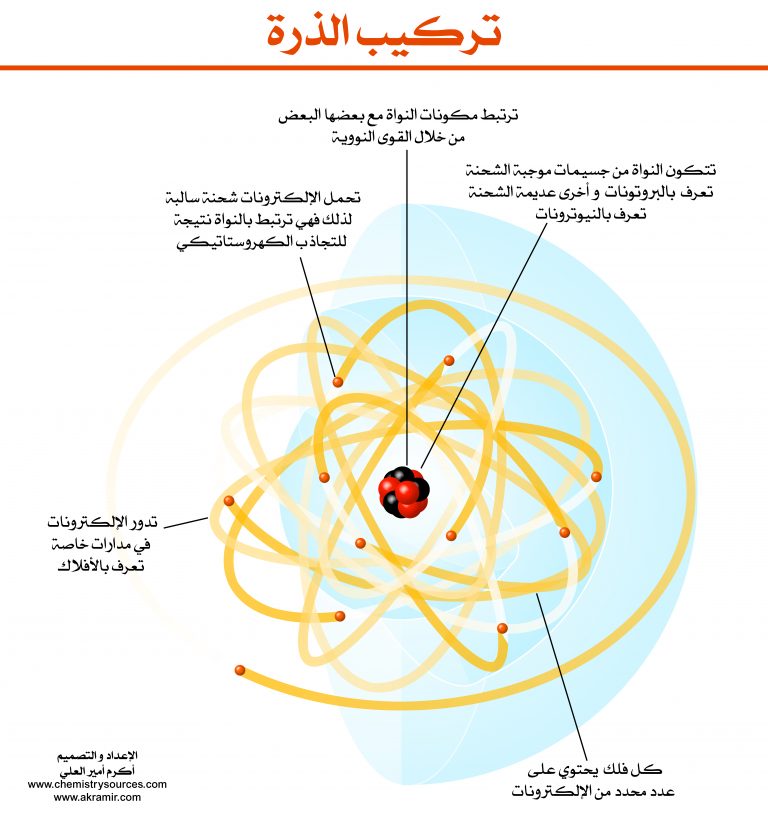
تتكون الذرة المتعادلة من نواة موجبة الشحنة محاطة بسحابة من الكترونات سالبة الشحنة، وعدد الإلكترونات الموجودة في السحابة يساوي عدد البروتونات الموجودة في النواة، مما يجعل الذرة متعادلة كهربائياً.
البروتونات

البروتونات هي جسيمات موجبة الشحنة وتوجد في نواة الذرة. وهي أثقل من الإلكترونات بحوالي 1836 ضعفًا وتبلغ شحنتها الموجبة الأساسية موجب واحد.
العامل الرئيسي الذي يساهم في كتلة الذرة هو عدد البروتونات الموجودة في نواتها. وكلما زاد عدد البروتونات، زادت كتلة الذرة.


عدد البروتونات في نواة ذرة معينة يحدد العنصر الكيميائي لتلك الذرة. على سبيل المثال، تحتوي جميع ذرات الهيدروجين على بروتون واحد، بينما تحتوي ذرات الكربون على ستة بروتونات، وهكذا.
النيوترونات

النيوترونات هي جسيمات متعادلة الشحنة وتوجد في نواة الذرة. وهي أثقل قليلاً من البروتونات، حيث يبلغ كتلتها حوالي 1839 ضعف كتلة الإلكترون.
النيوترونات مهمة في الحفاظ على استقرار النواة الذرية. وهي تساعد على التغلب على القوى الكهروستاتيكية التنافرية بين البروتونات الموجبة الشحنة.
عدد النيوترونات في نواة ذرة معينة يمكن أن يختلف، مما يؤدي إلى وجود نظائر مختلفة للعنصر نفسه. على سبيل المثال، يحتوي الكربون-12 على ستة بروتونات وثمانية نيوترونات، بينما يحتوي الكربون-14 على ستة بروتونات وثمانية نيوترونات.

الإلكترونات
الإلكترونات هي جسيمات سالبة الشحنة وتوجد في سحابة حول نواة الذرة. وهي أخف بكثير من البروتونات أو النيوترونات، حيث تبلغ كتلتها حوالي 1/1839 من كتلة البروتون.
الإلكترونات مهمة في التفاعلات الكيميائية. وهي مسؤولة عن الروابط التي تحدث بين الذرات لتكوين جزيئات ومركبات.
تحدد مستويات طاقة الإلكترونات خصائص الذرة الكيميائية. وكلما زاد مستوى الطاقة للإلكترون، كان أكثر تفاعلاً.
العدد الذري
العدد الذري لذرة هو عدد البروتونات الموجودة في نواتها. وهو يحدد العنصر الكيميائي لتلك الذرة.
يُستخدم العدد الذري للذرة أيضًا لتحديد موقعها في الجدول الدوري للعناصر. يتم ترتيب العناصر في الجدول الدوري بترتيب تصاعدي للعدد الذري.
الذرات التي لها نفس العدد الذري هي ذرات لنفس العنصر الكيميائي، حتى لو كان لها عدد مختلف من النيوترونات.
الكتلة الذرية
الكتلة الذرية للذرة هي كتلة نواتها بالإضافة إلى كتلة إلكتروناتها. وهي تُقاس بوحدات الكتل الذرية (amu).
الكتلة الذرية لذرة معينة تعتمد على عدد البروتونات والنيوترونات في نواتها. كلما زاد عدد البروتونات والنيوترونات، زادت الكتلة الذرية.
تستخدم الكتلة الذرية للذرات لحساب الوزن الذري للعناصر. الوزن الذري لعنصر هو متوسط كتلة ذرات جميع النظائر الطبيعية لذلك العنصر، مع مراعاة وفرتها النسبية.
الشحنة الكهربائية
الشحنة الكهربائية للذرة هي الفرق بين عدد البروتونات الموجبة الشحنة الموجودة في نواتها وعدد الإلكترونات السالبة الشحنة الموجودة في سحابة الإلكترون.
إذا كان عدد البروتونات يساوي عدد الإلكترونات، فإن الذرة متعادلة كهربائيًا. وإذا كان عدد البروتونات أكبر من عدد الإلكترونات، فإن الذرة موجبة الشحنة. وإذا كان عدد الإلكترونات أكبر من عدد البروتونات، فإن الذرة سالبة الشحنة.
الشحنة الكهربائية للذرة مهمة في تحديد تفاعلاتها مع الذرات الأخرى. تتجاذب الذرات ذات الشحنات المختلفة، بينما تتنافر الذرات ذات الشحنات المتشابهة.
الاستنتاج
الذرات المتعادلة هي اللبنات الأساسية التي يتكون منها كل شيء في الكون. وهي تتكون من نواة موجبة الشحنة محاطة بسحابة من الإلكترونات السالبة الشحنة. وعدد الإلكترونات في السحابة يساوي عدد البروتونات في النواة، مما يجعل الذرة متعادلة كهربائياً.