( قانون شارلز )
قانون شارل
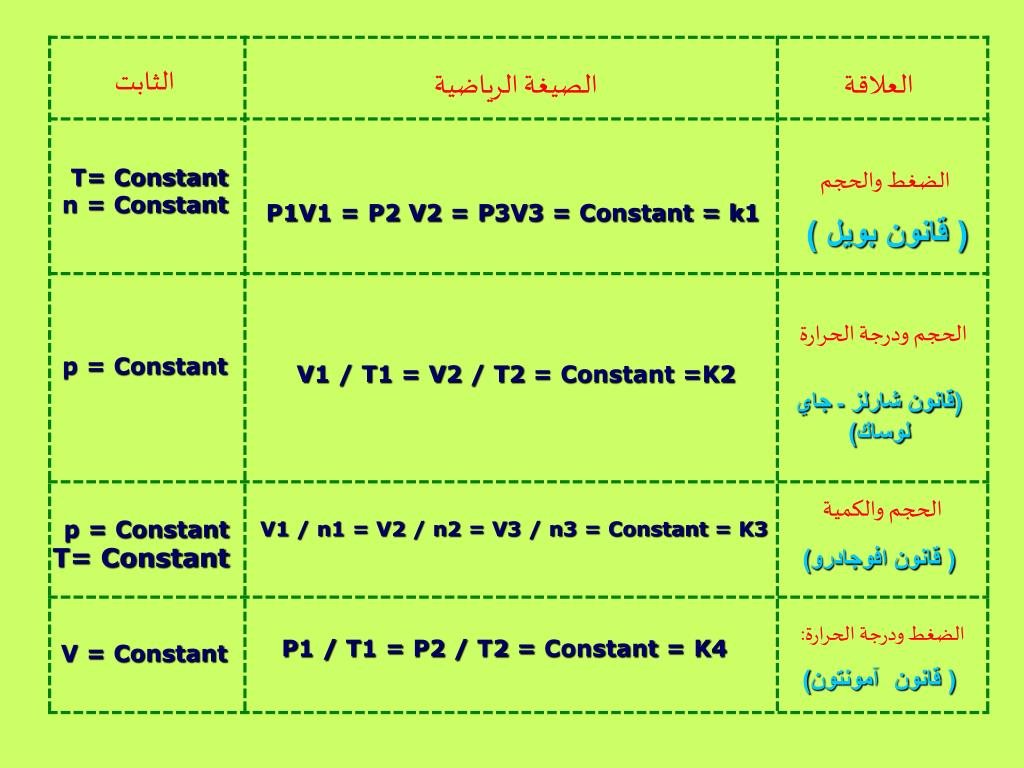
يُعرف قانون شارل، المعروف أيضًا باسم قانون الحجم-درجة الحرارة، العلاقة بين حجم الغاز ودرجة حرارته عند ثبات الضغط.
العلاقة الرياضية
يصاغ قانون شارل بصيغة رياضية على النحو التالي:
V/T = ثابت

حيث:
- V هو حجم الغاز
- t هي درجة الحرارة المئوية

تطبيقات قانون شارل
يستخدم قانون شارل في مجموعة واسعة من التطبيقات، بما في ذلك:
- قياس درجة الحرارة باستخدام مقياس حرارة الغاز
- تحديد معدل التفاعلات الكيميائية
- تصميم المحركات والأنظمة الحرارية
دليل قانون شارل
يمكن توضيح قانون شارل من خلال التجربة التالية:
- املأ وعاءًا بحجم ثابت بالغاز عند درجة حرارة الغرفة.
- قم بتسخين الغاز تدريجيًا.
- لاحظ أن حجم الغاز يتزايد مع زيادة درجة الحرارة.

المعاملات الحرارية والاستثناءات
ينطبق قانون شارل على الغازات المثالية تحت ظروف الضغط العالي. ومع ذلك، قد تنحرف الغازات الحقيقية عن هذا القانون في درجات حرارة منخفضة أو ضغوط عالية.

أمثلة على استخدام قانون شارل
- إذا تضاعف حجم الغاز، تتضاعف درجة حرارته أيضًا.
- إذا انخفض حجم الغاز إلى النصف، تنخفض درجة حرارته أيضًا إلى النصف.
- إذا تمت مضاعفة درجة حرارة الغاز، يتضاعف حجمه أيضًا.

حدود قانون شارل
ينطبق قانون شارل على الغازات المثالية فقط. في درجات الحرارة والضغوط العالية، قد تنحرف الغازات الحقيقية عن هذا القانون. لذلك، يجب توخي الحذر عند تطبيق قانون شارل على الغازات غير المثالية.
الخلاصة
يُعد قانون شارل مبدأً أساسيًا في الفيزياء والكيمياء. يوفر إطارًا لفهم العلاقة بين حجم الغاز ودرجة حرارته. يستخدم قانون شارل في مجموعة واسعة من التطبيقات العملية، ويعتبر أداة لا غنى عنها في دراسة سلوك الغازات.